

轩竹生物的I类创新药KM602、KM501与XZP-6877,分别于近期获得中国国家药品监督管理局批准开展临床试验。
KM602(临床批件编号:2023LP00251)是国内首个CD80 Fc融合蛋白类产品,有望成为FIC上市药物。KM501(临床批件编号:2023LP00278)是国内外首个完全敲除岩藻糖的双特异抗体ADC药物,具备成为BIC药物潜质。XZP-6877(临床批件编号: 2023LP00456、2023LP00457、2023LP00458)为国内首个DNA-PK抑制剂,有望填补国内该领域的市场空白。
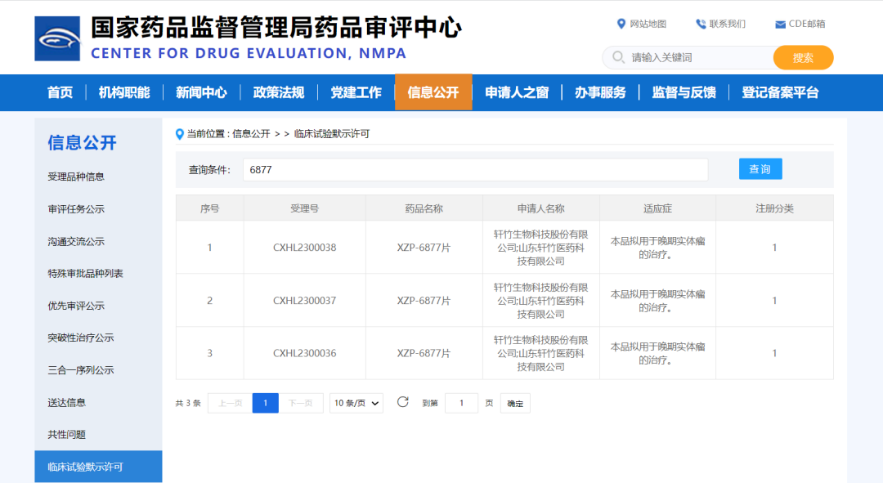
一、XZP-6877
XZP-6877是轩竹生物自主研发的选择性DNA依赖性蛋白激酶(DNA-PK)抑制剂,通过抑制DNA-PK的表达或活性来减少DSB(双链DNA断裂)的修复,从而提高肿瘤细胞对于放化疗的敏感性,增强抗肿瘤的疗效。可联合化疗、放疗等手段治疗晚期实体瘤的治疗。同时,抑制DNA-PK还可以破坏DNA端粒结构的稳定性,进而抑制肿瘤细胞的增殖生长。两方面的共同作用可以更有效地控制肿瘤。
XZP-6877已完成药代动力学研究和药毒理学评价,显示对DNA-PK的高抑制活性;在三阴乳腺癌模型、小细胞肺癌动物模型和头颈癌模型等多个药效模型上显示出放疗、化疗治疗增效,具备广谱抗癌潜力。动物药效模型亦显示,6877可以延长生存时间,为提高患者生存期提供了新的探索方向。
目前全球尚无DNA-PK上市药物,有6款进入临床阶段的DNA-PK药物,进度最快的处于临床Ib/II期;中国暂无DNA-PK抑制剂的在研管线。
XZP-6877为国内首个DNA-PK抑制剂,研发进度领先,具有技术优势,临床前数据显示具有较好的成药性,有望填补国内该领域的市场空白。
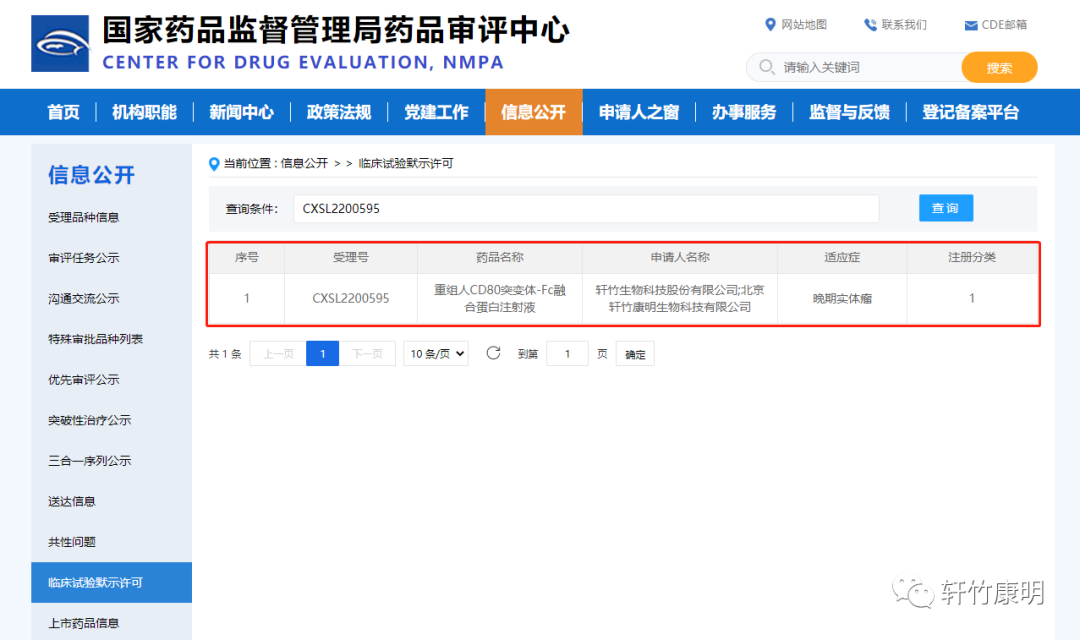
二、KM501
KM501为靶向HER2两个不同结构域双特异性抗体ADC偶联物,是轩竹康明通过具有自主知识产权的Mebs-Ig(抗体编辑的双特异性抗体)平台设计的双抗ADC,适用于治疗HER2阳性/表达、扩增或突变的局部晚期/转移性实体瘤,包括HER2低表达的相关晚期肿瘤。
从目前HER2双抗ADC的临床前数据看,针对HER2高中低表达的晚期实体瘤,双特异性抗体ADC的临床药效预期有望优于单抗或单抗联用+放化疗以及单抗ADC。全球HER2靶点的抗体治疗药物市场规模已超过126亿美元,KM501作为国内外首个完全敲除岩藻糖的双特异抗体ADC药物,预计未来上市后,有望在市场中迅速放量,市场潜力巨大。
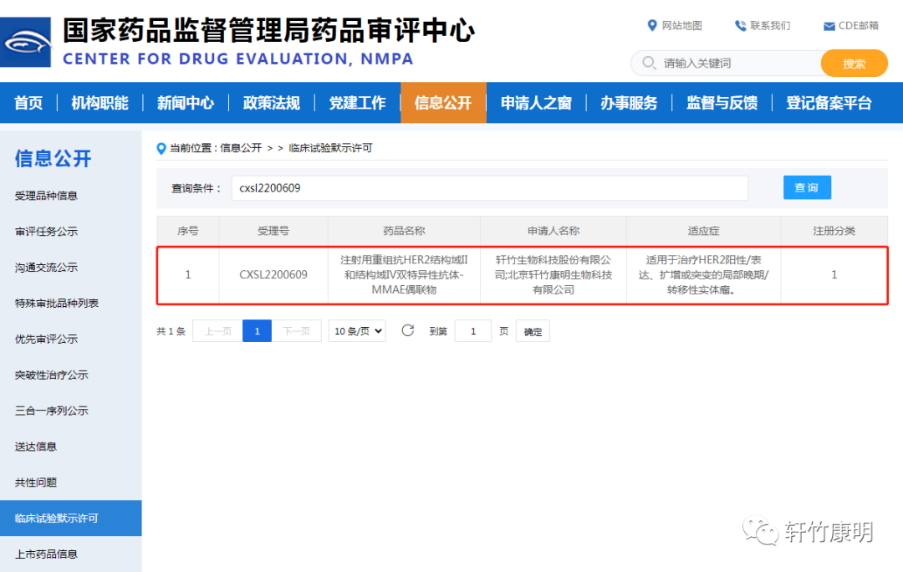
三、KM602
KM602为轩竹生物开发的一款免疫激动剂药物,通过计算机辅助分子优化设计和海量的动物药效筛选,确定了CD80胞外区IgC domain多位点突变分子实体,通过与IgG1的Fc构成的CD80突变体-Fc融合蛋白,拟定适应症为晚期实体瘤。
维持CD80/CD28信号通路的活性,是解决免疫耐药和效率低下问题的重要思路。KM602利用CD80-Fc融合蛋白的多效性,通过激活CD28共刺激信号以及对CTLA-4抑制信号解除等多条通路激活T细胞,起到杀伤肿瘤细胞作用。治疗后KM602可以明显改善肿瘤免疫微环境,并产生长效的免疫记忆反应,阻止肿瘤的复发。
目前国际上仅有一款同类产品处于临床I期研究阶段,国内尚没有厂家申报。KM602临床试验的获批,将进一步实现轩竹生物在乳腺癌的“全科室”布局,以及丰富中国生物制药在肿瘤领域创新药的产品管线,为广大的恶性肿瘤患者带来全新的治疗选择。

北京市朝阳区金和东路20号院正大中心北塔9层
9th Floor, North Tower of CP Center, No.20 Jin He East Avenue,Chaoyang District,Beijing,China
电话(T):010-5765 4567
邮箱(E):XZGROUP@xuanzhubio.com
Copyright © 轩竹生物科技有限公司保留所有权利 冀ICP备2020028968号

